

3-芳基哌啶结构广泛存在于具有生物活性的小分子化合物中。已知的合成方法大多需要通过较为繁琐的步骤构建哌啶环或进行3-位官能团转化,最终得到氮原子有保护基的三级胺产物。同时,该类化合物的不对称合成研究较少。因此,发展新的方法由简单易得的原料便捷地合成3-芳基哌啶类化合物是一个重要研究方向。

近日,我院陈伟杰研究员课题组与美国佛罗里达大学Daniel Seidel教授合作,基于有机合成中少有研究的环内1-氮杂烯丙基负离子中间体,通过钯催化芳基化反应实现了无保护顺式-2,3-二芳基哌啶化合物的快速合成,并实现了这一反应的不对称化。相关成果“Palladium-Catalyzed Arylation of Endocyclic 1-Azaallyl Anions: Concise Synthesis of Unprotected Enantioenriched cis-2,3-Diarylpiperidines”以Communication的形式在线发表于化学领域国际著名学术期刊《德国应用化学》(Angewandte Chemie International Edition, 2023, e202307638)。
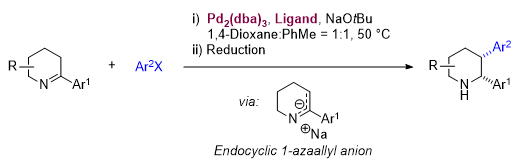
图1. 钯催化环内1-氮杂烯丙基负离子的芳基化反应(图片来源:Angew. Chem. Int. Ed.)
在前期研究基础上,作者由哌啶出发通过两步反应合成了底物2-芳基-1-哌啶亚胺。通过叔丁醇钠去质子化,2-芳基-1-哌啶亚胺原位生成相应的环内1-氮杂烯丙基负离子,并在Pd2(dba)3/XPhos催化下与芳基氯发生偶联反应得到2,3-二芳基-1-哌啶亚胺,随后通过硼氢化钠还原以中等至较高的收率和高非对映选择性得到氮原子无保护的顺式2,3-二芳基哌啶。该反应适用于烯基氯、含有杂芳基的底物,以及多取代1-哌啶亚胺底物。由于环内1-氮杂烯丙基负离子是两可的亲核中间体,对于大多数底物反应还同时得到少量N,3-二芳基化烯胺副产物。
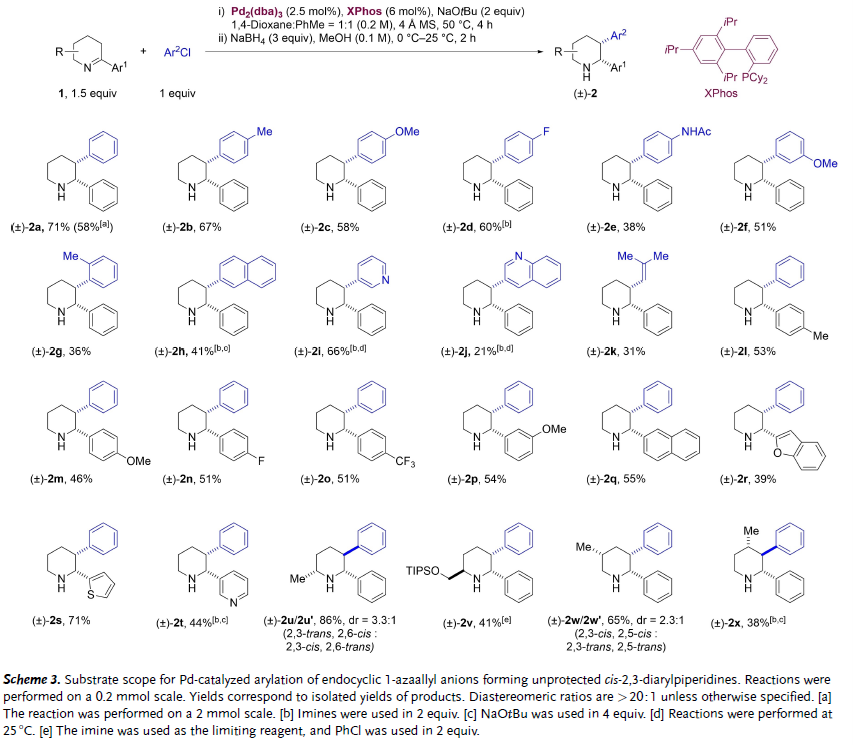
图2. 消旋反应底物扩展(图片来源:Angew. Chem. Int. Ed.)
作者进一步利用手性单膦配体实现了该反应的不对称化。研究发现,对于不对称反应,使用溴苯作为亲电芳基化试剂和降低碱的量显著提高了反应的对映选择性,同时亚胺当量由1.5倍增加至2倍能够提高目标产物的收率。大多数底物在Pd2(dba)3/(2R, 3R)-iPr-BI-DIME催化下能够以中等至较高的收率和对映选择性得到目标产物。
该方法的最终产物为氮原子无保护的二级胺,因而通过氮原子官能团化或区域选择性的α’-C–H键官能团化,顺式-2,3-二芳基哌啶可以便捷地进一步衍生为许多结构复杂的多取代哌啶化合物。
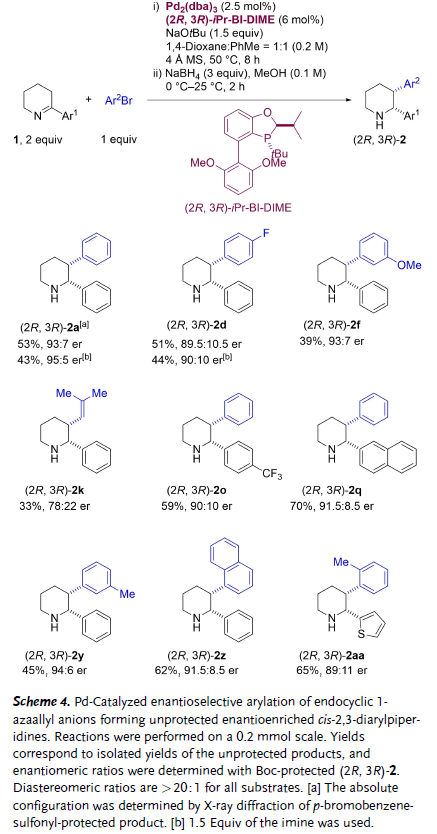
图3. 钯催化环内1-氮杂烯丙基负离子的不对称芳基化反应(图片来源:Angew. Chem. Int. Ed.)
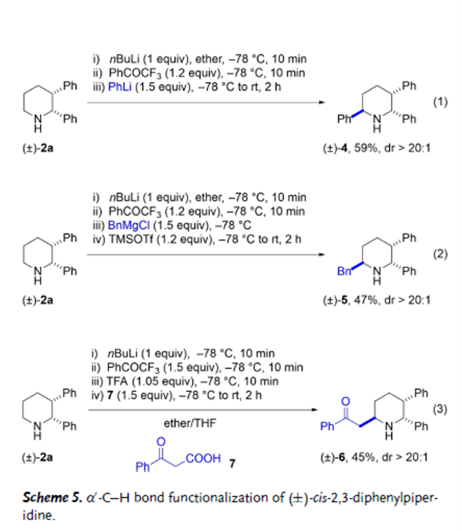
图4. 无保护顺式-2,3-二芳基哌啶的区域选择性α’-C–H键官能团化(图片来源:Angew. Chem. Int. Ed.)
环内1-氮杂烯丙基负离子由于制备方法的缺乏、结构的不稳定和两可亲核性,此前对其在有机合成中的应用研究很少。该工作报道了首例基于环内1-氮杂烯丙基负离子的过渡金属催化的偶联反应,极大地扩展了环内1-氮杂烯丙基负离子作为有机合成中间体的价值,实现了由哌啶出发高效对映选择性地合成无保护多取代哌啶化合物。
该研究工作得到了国家自然科学基金委、中央高校基本科研业务费以及美国国立卫生研究所资助,陈伟杰研究员为论文第一通讯作者,我院2022级博士生张彪为论文第一作者,同济大学为论文第一通讯单位。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202307638


