

阿尔兹海默病(AD)严重困扰老年人口健康,且缺少有效临床防治方法,是当今面临“老龄化”的社会急需解决而又尚未解决的难题。从天然产物中筛选活性物质,虽为AD新药研发提供了宝贵资源,但距离获得特效药物的目标还很远。因此,创新药物发现策略、以更加有效的方式寻找新的先导化合物,成为科学研究的重要任务之一。我院姚天明教授领衔的化学生物学课题组长期致力于Tau蛋白应用于重要疾病的治疗。日前,该课题组提出阿尔兹海默病药物先导化合物发现新策略:通过分子形变设计,发现Tau蛋白自聚集抑制剂,阻止产生神经纤维性缠结。相关研究成果“Molecular Deformation is a Key Factor in Screening Aggregation Inhibitor for Intrinsic Disordered Protein Tau”在线发表于国际知名期刊ACS Central Science。
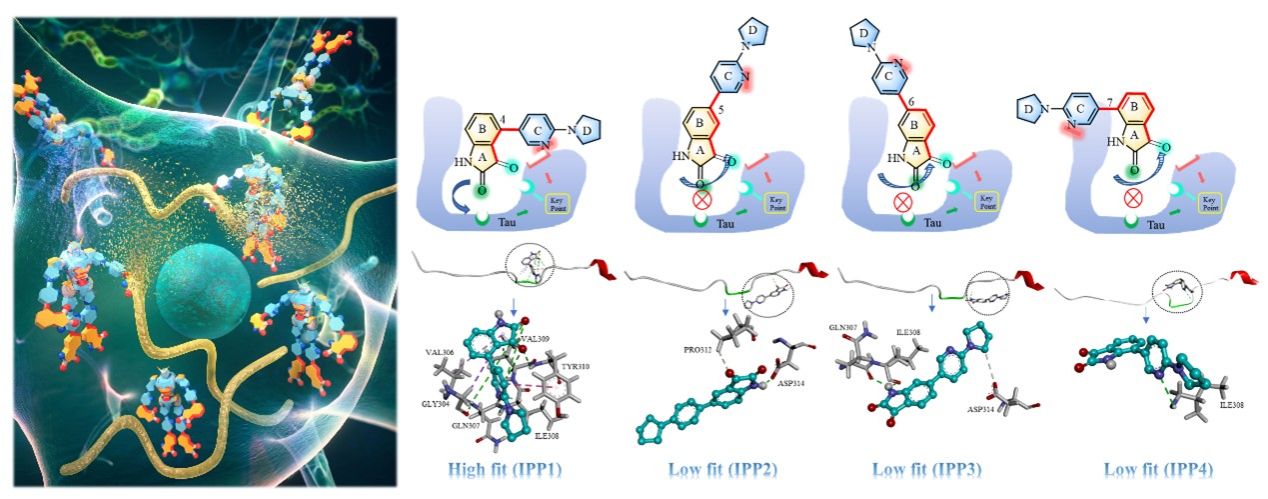
研究人员深度把控Tau蛋白结构特性,跳出针对结构有序蛋白的“酶和底物”热力学结合的一般药物设计模型,提出创新的设计思路,关注于tau肽链高度松散、结构无序的特殊性,寻找肽链关键片段,并以此为模板,通过药物配体横向结合形成“分子夹”束缚肽链自由翻转,阻断肽链错误折叠的动力学通道,抑制其自聚集。该项研究通过靛红、吡咯烷基吡啶模块化分子片段,以不同取代位置、不同方向进行拼接组装,获得一组形状各异的“分子变形金刚”,让先导化合物配体分子通过氢键、电荷、亲水疏水等超分子作用,识别伸展状态(一维或低于二维)tau肽链,通过形变筛选tau自聚集抑制剂。相关实验结果表明,分子的形状对Tau自聚集的抑制效果起关键的作用。只有特定形状的化合物,才能够以类似于核酸链间的碱基配对一样,实现完美匹配,从而阻止肽链错误折叠,发挥其抑制tau聚集的活性,甚至可以解聚tau聚集体。作为新先导化合物的发现,研究人员在细胞层次和AD小鼠模型上验证了特定形状的分子阻止tau的积累过程。该项工作为今后AD药物研发提供了一种新的设计策略。
论文通讯作者为姚天明教授,第一作者是化学科学与工程学院博士研究生柴可可。该项工作得到了国家自然科学基金、上海市自然科学基金和中央高校基本科研经费的支持。
文章链接:https://doi.org/10.1021/acscentsci.3c01196


